强直性肌营养不良1型(DM1)作为全球范围内最常见的成人肌营养不良亚型,其疾病进展为患者带来沉重负担。患者临床表现为由四肢远端起始的肌无力、肌萎缩以及明显的肌强直现象,症状逐渐向近端发展,目前在全球范围内尚无能够改变疾病进程的特异性疗法。
DM1的发病机制虽已较为明确,但有效治疗药物的缺失使得该疾病领域存在巨大的未满足临床需求。这一现状也凸显了DM1治疗领域对新疗法的迫切期待。
破局利器:精准递送的创新疗法
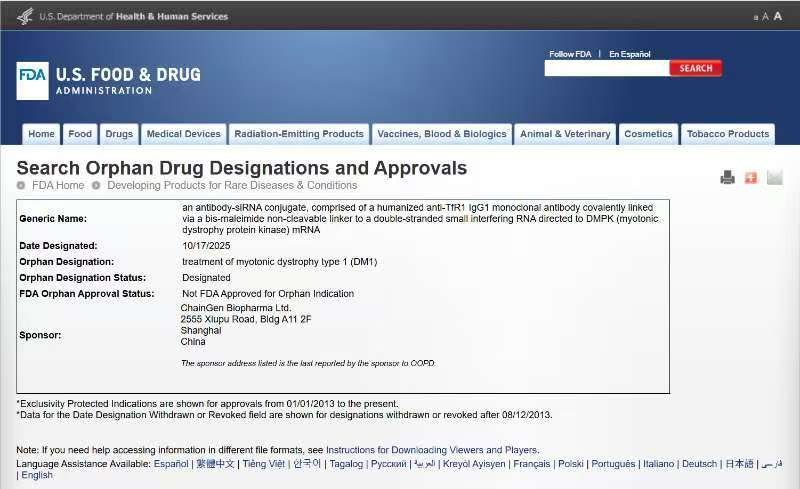
迦进生物核心产品CGB1001是国内首个针对DM1的TfR1抗体-siRNA偶联药物,采用先进的抗体偶联技术,实现了siRNA的精准靶向递送。这种创新设计犹如为药物装上了“精准导航系统”,能够高效穿透细胞屏障,特异性沉默致病基因。
作为国内首批专注于抗体寡核苷酸偶联药物研发的企业,迦进生物凭借CGB1001成功填补了国内在该领域的空白。目前,该产品已完成包括体外、小鼠及非人灵长类在内的全面临床前研究,并获得令人鼓舞的研究数据。
认定价值:孤儿药资格的战略意义
美国FDA的孤儿药资格认定是针对患病人数低于20万的罕见病药物设立的特殊认定制度。这一资格将为CGB1001的后续研发和商业化带来实质性利好,包括临床试验费用税收减免、新药申请用户费减免,以及药物获批上市后享有的7年市场独占期。
在国际竞争中,目前仅有Avidity Biosciences和Dyne Therapeutics等少数公司布局DM1治疗领域,且均处于临床试验阶段。CGB1001此次获得孤儿药认定,不仅体现了其创新价值,更为其后续参与全球竞争奠定了坚实基础。
迦进生物CGB1001获得FDA孤儿药认定,是中国创新药企在全球罕见病治疗领域迈出的重要一步。随着该产品的后续开发推进,有望为全球DM1患者带来新的治疗希望,同时也展现了中国生物医药企业在高端创新药研发领域的实力与决心。