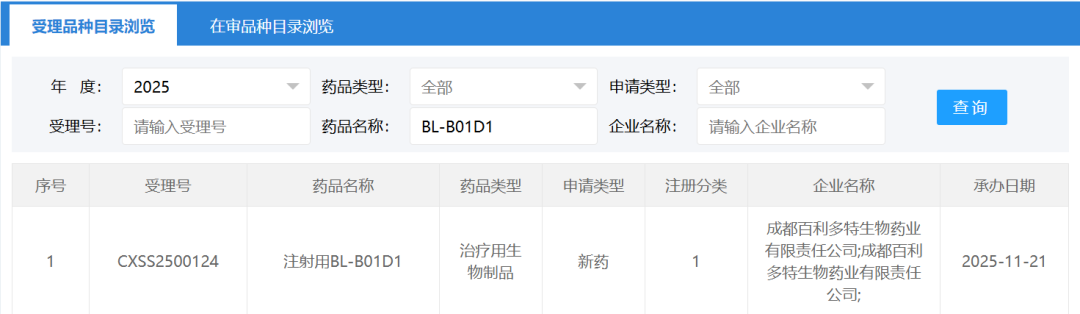
突破性疗法:双抗ADC开启肿瘤治疗新纪元
iza-bren作为全球首创且目前唯一进入III期临床阶段的EGFR×HER3双抗ADC药物,其首个适应症瞄准临床需求迫切的复发性或转移性鼻咽癌。此次新药上市申请基于BL-B01D1-303研究的III期临床试验期中分析结果,该研究在既往经PD-1/PD-L1单抗治疗且至少两线化疗失败的鼻咽癌患者中达到了主要研究终点。
值得注意的是,iza-bren已获得CDE的7项突破性疗法认定和美国FDA的1项突破性疗法认定。2025年9月5日,CDE已正式将该药物纳入优先审评审批程序,将加速其上市进程,为患者带来新的治疗希望。
临床价值:破解鼻咽癌后线治疗困境
鼻咽癌作为一种具有明显地域分布特征的恶性肿瘤,在中国南方、东南亚等地区高发,且与EB病毒感染密切相关。尤其值得关注的是,转移性鼻咽癌后线患者的5年总体生存率通常低于10%,临床存在显著的未满足需求。
iza-bren在这一难治人群中获得的重要突破,为晚期鼻咽癌患者提供了新的治疗选择。其独特的双抗ADC设计,同时靶向EGFR和HER3两个关键信号通路,有望克服现有治疗方案的局限性,改善患者的生存预后。
全球布局:近40项临床试验同步推进
截至2025年9月,百利天恒正在中国和美国就iza-bren开展近40项针对多种肿瘤类型的临床试验。其中,在中国正在开展10项不同癌种的III期临床注册研究,其中7项适应症已被CDE纳入突破性治疗品种名单。
在国际合作方面,百利天恒与战略合作伙伴百时美施贵宝公司共同在美国开展一线晚期三阴性乳腺癌、EGFR-TKI耐药后晚期非小细胞肺癌等多个II/III期临床试验。iza-bren的研究成果已在ASCO、ESMO、SABCS等全球顶级学术会议报道,并在《柳叶刀·肿瘤学》发表全文,展现出优秀的疗效信号和良好的安全性数据。
业内专家认为,iza-bren的成功进展不仅体现了中国创新药企的研发实力,更为全球ADC药物研发开辟了新的方向。随着上市申请的推进,该药物有望为更多肿瘤患者提供新的治疗选择。