非达霉素具有以下作用:是一种大环内酯类抗生素,口服后通过在异丁酰酯处水解,将非达索霉素转化为其主要的和具有药理活性的代谢物OP-1118,通过在转录周期起始阶段抑制细菌RNA聚合酶来介导对艰难梭菌的杀菌活性。除艰难梭菌外,非达霉素对革兰氏阳性菌(金黄色葡萄球菌和肠球菌属)具有中等抑制作用,对正常结肠菌群(包括厌氧菌和肠道革兰氏阴性杆菌)的活性较弱。主要在粪便中排泄,目前未有非达霉素可以抑制Notch信号通路,具有抗肿瘤作用的报道。
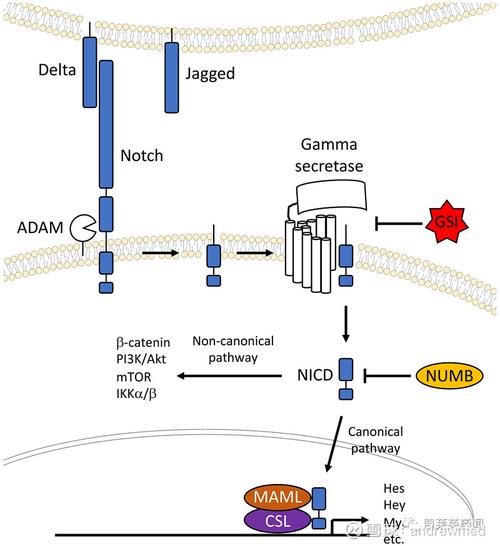
如上所示,本发明提供了非达霉素的新用途,通过抑制Notch信号通路来达到抗肿瘤的作用。
发明内容
本发明提供了一种药物非达霉素,该药物是FDA批准上市药物,能够用于制备具有抑制Notch通路与抗肿瘤作用的药物。
本发明提供的非达霉素,非达霉素能够用于制备Notch通路抑制剂,通过抑制Notch通路导致其抗肿瘤作用;抑制Notch信号通路包括但不限于抑制Notch通路关键转录因子RBP-jk,改变Notch协同因子或效应因子的表达或功能。
非达霉素对急性T淋巴细胞性白血病细胞T-ALL、Luminal型人乳腺癌细胞系MCF-7、三阴性乳腺癌细胞系MDA-MB-231和小鼠乳腺癌细胞系4T1均具有一定的抑制作用。其对Jurkat细胞的IC
本发明证实,可以使用Notch通路抑制剂非达霉素治疗的肿瘤,其发病往往与Notch通路异常激活有关,因此可以使用Notch抑制剂,如DAPT、siRNA、microRNA以及抗体等治疗可以使用非达霉素治疗的肿瘤,或联合使用非达霉素和其他Notch通路抑制剂治疗可以使用非达霉素治疗的肿瘤。
附图说明
图1为非达霉素对人乳腺癌细胞系MCF-7的细胞毒性结果图。其中,非达霉素药物的给药浓度梯度为5μM、25μM、50μM、75μM、100μM,IC
图2为非达霉素对鼠源乳腺癌细胞系4T1的细胞毒性结果图。其中,非达霉素药物的给药浓度梯度为25μM、30μM、35μM、40μM、50μM,IC
图3为非达霉素对人乳腺癌细胞系MDA-MB-231的细胞毒性结果图。其中,非达霉素药物的给药浓度梯度为5μM、50μM、100μM、200μM、400μM,IC
图4为非达霉素对T细胞Jurkat的细胞毒性结果图。其中,非达霉素药物的给药浓度梯度为5μM、50μM、100μM、200μM、400μM,IC
图5为qRT-PCR检测Notch通路相关分子Notch1、HES1、HES5、HEY1在非达霉素(Fidaxomicin)药物分别作用24h、48h后的基因表达变化情况(mean±SD,n=3,*p
图6为Western blot检测Notch通路下游分子HES1、HES5在非达霉素药物作用24h(A)与48h(B)后的蛋白表达变化情况。GAPDH为内参蛋白,C24表示使用完全培养基孵育细胞24h,M24表示非达霉素药物孵育4T1细胞24h,C48表示使用完全培养基孵育细胞48h,M48表示非达霉素药物孵育4T1细胞48h(mean±SD,n=3,***p
图7为非达霉素对4T1-荷瘤小鼠的肿瘤抑制效果图。Control组为瘤内注射生理盐水对照,F-1、F-2、F-3分别表示非达霉素高、中、低剂量组(mean±SD,n=5,**p<0.01,****p<0.0001,与Control组相比)。
图8为非达霉素对4T1-荷瘤小鼠体重影响图。
图9为Western blot检测Notch通路下游分子HES1(A)与HES5(B)在非达霉素药物不同剂量(50mg/kg、25mg/kg、5mg/kg)后肿瘤组织中蛋白表达变化情况。Control组为瘤内注射生理盐水对照,F-1、F-2、F-3分别表示非达霉素高、中、低剂量组(mean±SD,n=3,*p<0.05,**p<0.01,***p<0.001,****p
具体实施方式
以下结合附图通过具体的实施例对本发明作进一步描述,这些实施例仅用于说明本发明,并不是对本发明保护范围的限制。
实施例
实施例1非达霉素抑制T细胞Jurkat、Luminal型人乳腺癌细胞系MCF-7、三阴性乳腺癌细胞系MDA-MB-231及鼠源乳腺癌细胞系4T1的体外增殖实验
细胞种板:T-ALL、MCF-7、MDA-MB-231和4T1细胞(均购自中科院上海细胞库)用完全培养基(MCF-7:含有体积分数10%的胎牛血清和体积分数为1%的青霉素-链霉素双抗的DMEM培养基;4T1、Jurkat、MDA-MB-231:含有体积分数为15%的胎牛血清和体积分数为1%的青霉素-链霉素双抗的RPMI1640培养基)接种于25T培养瓶,在37℃,5%CO2条件下培养48小时后,显微镜观察细胞生长状态,待细胞生长密度达到80%-90%后,即可进行传代。吸去25T培养瓶内原有培养基,取胰酶清洗两遍,弃去胰酶-培养基混合液后加入1mL胰酶,转移至培养箱中消化3-5min,显微镜下观察细胞变的圆润透明后加入2mL完全培养基终止消化,使用无菌吸管吹打瓶壁上细胞形成细胞悬液,1000rpm离心5min后弃去上清液,加入完全培养基吹打重悬细胞,使用排枪按照每孔100μL将细胞悬液均匀的种到96孔板中,在37℃,5%CO
细胞给药:按照预实验结果确定药物的浓度梯度(MCF-7:5μM、25μM、50μM、75μM、100μM;4T1:25μM、30μM、35μM、40μM、50μM;MDA-MB-231:5μM、50μM、100μM、200μM、400μM;Jurkat:5μM、50μM、100μM、200μM、400μM)将药物溶解到含有体积分数为0.1%的DMSO的培养基中,取96孔板去除原有培养基,加入不同浓度药物,每孔100μL,每个药物浓度设置5个复孔,余下孔加入100μL培养基作为空白对照,转移到细胞培养箱中培养48h。
细胞增殖活性检测:非达霉素孵育48h后,吸出孔内原有培养基,每孔加入100μL体积分数为5%的CCK-8试剂,转移至细胞培养箱中孵育1-2h。然后使用酶标仪在450nm处检测各孔的OD值。计算非达霉素对Jurkat、MCF-7、MDA-MB-231、4T1细胞的IC
计算结果显示,非达霉素对MCF-7、4T1、MDA-MB-231、Jurkat细胞的IC
实施例2非达霉素体外抑制Notch通路的验证实验
按照实施例1细胞种板操作步骤将4T1细胞接种于4块6孔板中,每组设置3个复孔,实验组每孔加入非达霉素(32.3μM)2mL,对照组每孔加入2mL RPMI1640培养基,分别置于培养箱中孵育24h、48h。具体实验分组如下表所示:
表1实验分组
qRT-PCR(检测RNA表达):
(1)RNA提取
分别处理不同时间点样本。首先,将六孔板中培养基吸出,使用2mL PBS清洗一次,加入500μL的Lysis Buffer,用力吹吸10次,转移至1.5mL离心管中涡旋10秒钟以充分裂解细胞,然后加入500μL无水乙醇充分混匀。混匀后将液体加入离心柱中12000g离心1min。向柱中加入500μL Wash Buffer,12000g离心1min,倒掉废液,将RNA柱装回收集管,空管离心一次除去残留的Wash Buffer。然后将柱子放到干净的无RNA酶的1.5mL离心管上。在RNA柱的膜中心位置加入20-30μL的Elution Buffer,室温静置2min后12000g离心1min,将洗脱下来的RNA溶液重新加入柱中,静置5min,使离心柱中残留的RNA充分溶解在Elution Buffer中,再次12000g离心1min,得到RNA溶液。
使用Nanodrop软件测定提取总RNA浓度与纯度。
(2)逆转录
根据测得的总RNA浓度计算1μg总RNA体积。取1μg总RNA加入八联管中,加入2μLDNA酶,加入Rnase水至16μL,用移液枪轻轻吹打10次,室温条件下放置5min,去除体系中含有的DNA。加入4μg的5×RT Mix,用移液枪吹打10次,充分混匀。在42℃条件下反应15分钟,稀释10倍后作为模板进行qPCR。
(3)qPCR
使用八联管按照表2配制qPCR反应体系。配制完成后用移液枪吹打反应体系,然后使用离心机将八联管中反应体系离心以达到充分离心的目的。
表2 qPCR反应体系
配置好反应体系,将八联管按照标定顺序依次放入LightCycler96实时荧光定量PCR仪的96孔板中。按照表3设置反应程序。
表3 qPCR反应程序
GAPDH作为内参,采用相对定量法进行分析。结果表明与对照组样本相比,分别给药24h、48h后,可以检测到基因Notch1、HES1、HES5、HEY1的表达显著下调(图3)。
Western blot(检测蛋白表达):
(1)细胞样本蛋白提取
使用2mL胰酶消化细胞转移至15mL离心管,500g离心5min后弃掉上清,向离心管中加入10mL预冷PBS,1000rpm离心10min,重复洗两次。加入1.5mL裂解液,超声破碎细胞,每次30sec,间隔1min,超声4次,14000rpm,4℃离心15min,取上清液即为全蛋白提取液。
(2)蛋白浓度测定
a.根据样本数量计算所需工作液总体积,使用改良型BCA蛋白浓度测定试剂盒。根据试剂盒说明书按照1×溶液A:溶液B体积比50:1的比例配制BCA工作液。
b.将改良型BCA蛋白浓度测定试剂盒中溶液D与蒸馏水按照体积比1:1比例稀释,混匀制得溶液E
d.取8支1.5mL离心管,按照试剂盒要求配制牛血清白蛋白(BSA)浓度为0、25、75、125、250、500、750、1000μg/mL的80μL体系,用于制作标准曲线。
e.采用酶标板法,取酶标板,分为标准组与样品组,每组设置1个复孔,其中16孔加入5μL相应浓度的标准蛋白质溶液,余下孔分别加入不同的5μL样品稀释液。然后,分别向每孔中加入5μL改良型BCA蛋白浓度测定试剂盒中溶液F,用移液枪迅速混匀,37℃水浴保温30min。
f.向每孔中分别加入200μL BCA工作液,用移液枪迅速混匀,37℃水浴保温30min。
g.待酶标板冷却至室温后,使用酶标仪在562nm条件下测定各孔的吸光度值。
h.根据结果绘制标准曲线,根据标准曲线函数计算样品的蛋白质浓度。
(3)聚丙烯酰胺凝胶电泳
a.取各实验组全蛋白提取液涡旋混匀,而后离心。根据标准曲线计算样品的蛋白浓度后,使用蛋白上样缓冲液、PBS稀释样品,使样品终浓度为2mg/mL。将稀释后的样品在100℃金属浴中煮10min,置于冰上待用。
b.分离胶的配制:由于目标蛋白的分子量都小于40kD,所以采用质量分数为15%的分离胶。使用上海生工SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒配制20mL质量分数为15%的分离胶。取50mL烧杯,分别加入4.8mL双蒸水、10mL质量分数为30%的Acr-Bis(acrylamide与bisacrylamide的质量比为29:1)、5mL Gel buffer A、0.2mL质量分数为10%的APS、0.012mL TEMED混匀。
c.用1mL移液枪吸取配制好的分离胶加入玻璃胶板中,然后缓慢加入双蒸水进行封闭去除分离胶中的气泡。
d.约30min后分离胶凝固。待分离胶凝固后,使用上海生工SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒配制6mL浓缩胶。取50mL烧杯,分别加入2mL双蒸水、1mL质量分数为30%的Acr-Bis(acrylamide与bisacrylamide的质量比为29:1)、3mL Gel buffer A、0.06mL质量分数为10%的APS、0.006mL TEMED混匀。将玻璃胶板上层双蒸水倒掉,用滤纸沿一侧将残留水分吸干,加入配置好的浓缩胶,并迅速插上梳子。
e.待浓缩胶凝固后。配制电泳液。使用上海生工的10×蛋白电泳缓冲液。电泳前,用去离子水稀释至1×蛋白电泳缓冲液。将胶板及电泳架放置到电泳槽内,加入适量电泳液,拔掉梳子。
f.样品震荡涡旋上样。Marker上样3μL,样品上样10μL,上样完毕后,将两块胶板之间的电泳液加满,随后按照正负极对应盖上盖子进行电泳。
g.首先,在80V条件下,运行30min,待Marker条带分离开后将电压调节至110V,运行70min。
(4)转膜
a.使用上海生工的10×转膜液。根据所需转膜缓冲液的体积,按照10×转膜液:去离子水:甲醇体积比为1:7:2的比例预先配制转膜液,置于4℃待用。
b.PVDF膜做好标记(样品名称),置于甲醇中激活。
c.倒掉电泳液,取出胶板,将凝胶切边,置于转膜缓冲液中,按照夹心法依次将海绵、滤纸、凝胶、PVDF膜、滤纸、海绵按照顺序放置好,小心去除凝胶和PVDF膜上的气泡。然后,按照PVDF膜位于阳极侧,凝胶位于阴极测的规则将夹板插入转膜架中,加入转膜缓冲液,接通电源,电泳槽周围加入冰袋低温300V 60min条件运行。
(5)封闭
用镊子将PVDF膜从夹板中取出,放入质量分数为5%的脱脂奶粉封闭液中(转膜侧朝上),置于摇床上缓慢摇动,室温封闭1h。
(6)一抗孵育
a.封闭完成后,弃去奶粉封闭液,加入适量TBST清洗PVDF膜,置于摇床上快速摇动,清洗3次,每次15min。
b.将HES1、HES5、GAPDH抗体按照说明书建议稀释比例稀释,然后将PVDF膜转移至对应抗体溶液中,4℃孵育过夜。
(7)孵育二抗
a.一抗封闭后,加入适量TBST清洗PVDF膜,置于摇床上快速摇动,清洗3次,每次15min。
b.将二抗按照体积比1:8000比例稀释,然后将PVDF膜转移至对应抗体溶液中,室温摇床上孵育2h。
(8)化学发光显影
a.二抗封闭后,将PVDF膜浸润至TBST缓冲液中,置于摇床上洗涤5次,每次15min。
b.取出ECL发光试剂盒,等量混合ECL发光试剂盒中Ⅰ液和Ⅱ液(皮克级),用平头镊子钳住PVDF膜,垂直置于吸水纸上吸取膜上TBST缓冲液,然后将膜置于混合液中反应,反应完成后,将PVDF膜吸附蛋白面朝上,置于X光片板上曝光。
扫描条带灰度值,以GADH作为内参,对各组的目的蛋白表达量进行分析。结果表明,在药物作用24h后,HES1、HES5蛋白均未出现明显的表达下调,在药物作用48h后,HES1、HES5蛋白表达量相较于对照组显著下调。与细胞在药物孵育24h后无明显凋亡,48h后明显凋亡相互印证。这说明非达霉素通过Notch通路,从而抑制肿瘤细胞增殖。
实施例3非达霉素对4T1-荷瘤小鼠的体内抑制肿瘤作用
通过建立4T1-荷瘤小鼠模型来考察非达霉素的体内抗肿瘤与Notch通路抑制作用,其方法与结果如下:
材料与分组:6-8周(体重20-22g)的雌性balb/c小鼠30只,实验分组为非达霉素高剂量组(F-1,50mg/kg)、非达霉素中剂量组(F-2,25mg/kg)、非达霉素低剂量组(F-3,5mg/kg)、阳性对照DAPT组(25mg/kg)、化药5-FU(25mg/kg)组、生理盐水组。
4T1-荷瘤小鼠模型构建:收集培养细胞悬浮于PBS中制备成1×10
给药:待肿瘤生长到体积大概100mm
肿瘤解剖:给药结束第二天使用二氧化碳窒息法处死小鼠,然后使用手术器械将给药组和模型组的小鼠解剖,完整剥离出肿瘤瘤组织。结果表明非达霉素中、高剂量组肿瘤体积与生理盐水组相比有显著差异(p
实施例4非达霉素体内抑制Notch信号通路
Western blot检测肿瘤组织中HES1、HES5的蛋白表达:
首先进行肿瘤组织中全蛋白提取,称取100mg肿瘤组织,手术剪剪碎肿瘤组织,尽量去除脂肪组织及结缔组织等非目的组织,用预冷PBS洗涤两次,离心取沉淀后加入1mL的预冷Lysis Buffer,使用电动组织匀浆器将肿瘤组织匀浆,置于冰上裂解10min,15000g,4℃条件下离心10min,取上清转移至新的预冷的离心管中,即为全蛋白提取物
然后根据实施例2中操作步骤分别进行电泳、转膜、封闭、一抗孵育、二抗孵育、化学发光显影与条带灰度值扫描。以GADH作为内参,对各组的目的蛋白表达量进行分析。结果表明,非达霉素高、中、低剂量组均显著下调Notch通路下游蛋白HES1、HES5的表达。












